
最終更新日:2024年10月17日
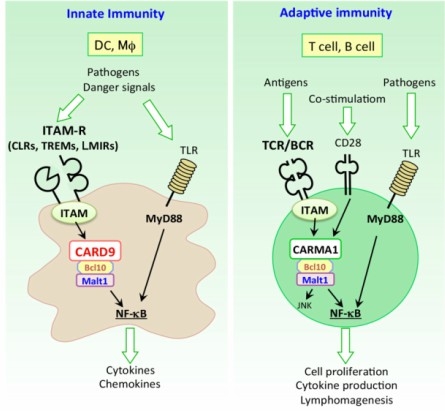
当分野では、ITAMモチーフを介してシグナルを活性化する免疫受容体とそのシグナル伝達分子に着目し、分子生物学的、遺伝子工学的手法を駆使してこれらの分子の生理機能の解明に取り組んでいます。これにより、感染症、がん、認知症など様々な疾患の発症・進展に関与する新規な機構を見出し、新しい概念での治療法の確立を目指します。
【ラボメンバー募集中!】
当分野では多様な人材を随時募集しています。詳細は「人材募集」を御覧下さい。ラボのニュースや出来事は研究室公式「X」で発信しています!

研究室概要
| 部局 | 医歯学総合研究科 | Graduate School of Medical and Dental Sciences |
|---|---|---|
| 専攻 | 健康科学専攻 | Health Research Course |
| 大講座 | 感染防御学 | Infection and Immunity |
| 分野 | 免疫学 | Immunology |
| 研究室公式 Xアカウント |
https://twitter.com/kadaimeneki | |
連絡先
主要研究テーマ
| 病原性抗酸菌を認識するパターン認識受容体とそれらを介した免疫回避機構 | Pattern recognition receptors that recognize pathogenic mycobacteria and the immune evasion mechanisms by those receptors |
| βcサイトカイン受容体のシグナル伝達 | βc cytokine receptor signaling |
| 新規脂質誘導性マクロファージの機能と応用 | Functions and applications of novel lipid-inducible macrophages |
| 神経-免疫関連による痒みの制御 | Regulation of itch by neuroimmune system |
| 免疫抑制性好酸球による食物アレルギーの制御 | Regulation of food allergy by immunosuppressive eosinophils |
【はじめに:免疫システムを制御する異物センサー】
免疫システムは,外界から侵入してくる細菌・真菌、ウイルス、寄生虫などの病原体や、自らが発生する癌細胞などの‘危険な異物’を認識して攻撃し、これを排除する生体防御機構です。しかし、本来害のない環境物質を間違って攻撃してしまうと、花粉症や食物アレルギーなどのアレルギー疾患が生じてしまいます。さらに、免疫系には‘自己寛容’と呼ばれる自分自身を攻撃しない機構が備わっていますが、これに狂いが生じてしまうと、関節リウマチ、I型糖尿病、多発性硬化症、全身性エリトマトーデスなどの自己免疫疾患の原因となります。ヒトに感染する多くの病原体は、自分が異物として免疫系に悟られないようにしたり、免疫系の働きを弱めたりする巧みな仕組みを備えています。免疫力が弱まると、健康な人なら感染しないような微生物が感染症をひき起こしたり、簡単に癌が発生してしまったりします。また、免疫系は脳神経系や内分泌系の働きをも制御しており、認知症、慢性疼痛、精神疾患、生活習慣病などの発症にも関与することが明らかになってきています。従って、免疫系による自己と非自己の識別のしくみをよく理解し、これを体の状況に合わせてうまくコントロールすることができれば、様々な疾患の治療や予防が可能になると考えられます。
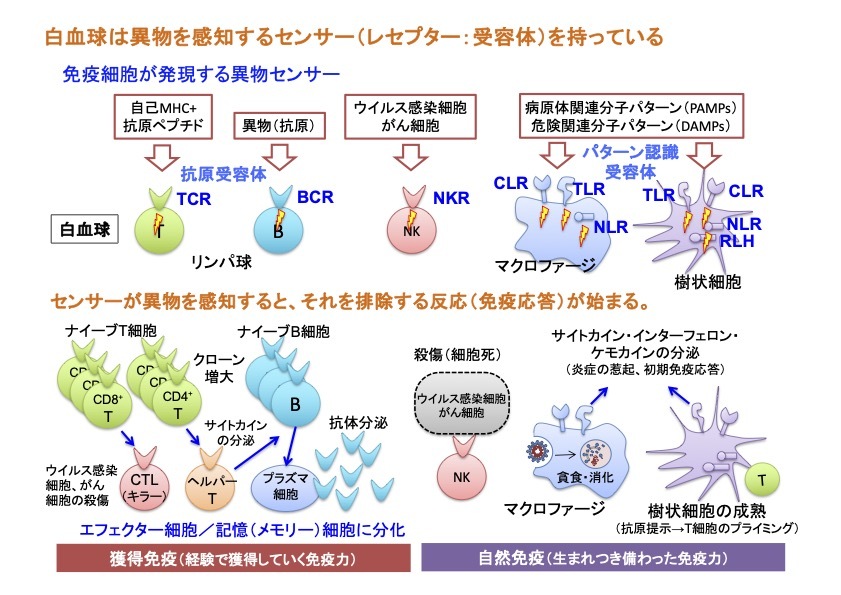
この免疫システムの根幹ともいえる‘危険な異物’の認識は、免疫細胞が発現する多種多様な‘異物センサー(受容体)’を介してなされます。免疫系は生まれもった免疫システムである「自然免疫」と、個々人が生きてきた環境に依存して獲得する「獲得免疫」に大別されます。この2つのシステムは、それぞれ違った仕組みで異物を認識する受容体を有しており、これら受容体を介した応答が正しく制御されることで免疫系の恒常性が保たれています(下図)。
「自然免疫」の受容体は、微生物に特有の分子パターン(微生物関連分子パターン: PAMPs)や、細胞がストレスやダメージを受けて死ぬ時に放出される内因性危険分子(ダメージ関連分子パターン: DAMPs)を認識して細胞を活性化します。これらを総称してパターン認識受容体(pattern recognition receptors: PRRs)と呼びます。一方、「獲得免疫」の応答は、リンパ球(T細胞とB細胞)が発現するリンパ球抗原受容体(T細胞受容体(TCR)とB細胞受容体(BCR))を介して生じます。TCRやBCRによって異物(抗原)を感知してリンパ球が活性化すると、抗体産生B細胞(プラズマ細胞)、ヘルパーT細胞(Th)、細胞傷害性T細胞(CTL)といった攻撃力を持ったエフェクター細胞に変化(分化)して抗原の排除に働きます。さらに、一度遭遇した抗原を記憶するメモリー細胞となって体の中に残り、同じ抗原が再び侵入した際に、より迅速に異物の排除を行います。このリンパ球による‘免疫記憶’の原理を利用したものがワクチンです。
免疫細胞が細胞表面のPRRsやリンパ球抗原受容体によって異物を認識すると、細胞内にその信号(シグナル)が伝達されて核に伝わり、異物の排除に関わる様々な遺伝子の発現が誘導されて免疫応答が生じます。活性化した免疫細胞はサイトカインと呼ばれる細胞間の情報伝達を行うタンパク質を分泌し、これが他の免疫細胞や非免疫細胞に発現するサイトカイン受容体に働いて、その細胞を活性化したり、逆に制御したりすることで免疫応答をコントロールします。我々の研究室では、こうした免疫の受容体が異物やサイトカインを認識し、その信号(シグナル)を核に伝え、免疫細胞を活性化するしくみを分子レベルで解き明かそうとしています。また、これらの免疫受容体を介した応答が、感染微生物や癌に対する生体防御や、アレルギー疾患、自己免疫疾患、神経疾患の発症にどのように関わるかを解き明かそうとしています。さらに、これまで明らかにした発見をもとに、免疫細胞を用いた革新的な治療法の開発にも取り組んでいます。我々の研究によって多くの人が病気の苦しみから解放され、健やかな人生を送れることを心より望みます。
①病原性抗酸菌を認識するパターン認識受容体とそれらを介した免疫回避機構
【概要】
抗酸菌の一種である結核菌は世界人口の約四分の 1 が保有し、毎年 150 万人以上もの人が結核によって命を落としています。私たちは抗酸菌結合能を有する ITAM 共役型受容体のスクリーニングを実施した結果、DAP12 会合型TREM2 が抗酸菌細胞壁のミコール酸(MA)に強い親和性を有することを見出しました(Iizasa et al. Nat Commun., 2021)。Trem2欠損マウスを用いた解析から、TREM2 の活性化は抗酸菌の増殖に寄与する許容的マクロファージの誘導を促すとともに、強力な免疫賦活効果を持つ抗酸菌細胞壁成分TDMを認識するMincle を介した殺菌的免疫応答を抑制して抗酸菌の免疫回避に関わっている可能性が示唆されました。現在、高病原性結核菌感染やハンセン病の原因菌であるらい菌感染におけるTREM2の機能解明をおこなっています。
②βcサイトカイン受容体のシグナル伝達
【概要】
IL-3、GM-CSF、IL-5は、その構成要素に共通のβ鎖(βc)を持つことからβcファミリーサイトカインと呼ばれています。IL-3はさまざまな血球系前駆細胞の分化や増殖を促す造血因子であり、GM-CSFは骨髄系細胞の造血を促すとともに、その活性化も促進して、炎症性疾患、感染症、自己免疫疾患の発症、増悪に寄与することが知られています。また、IL-5は好酸球の動員および活性化を促して、喘息やアトピー性皮膚炎などのアレルギー疾患の増悪に関わります。我々は、これらβcファミリーサイトカインの受容体がシグナルを細胞内に伝達し、免疫細胞を活性化する分子メカニズムの解明に取り組んでいます。
③新規脂質誘導性マクロファージの機能と応用
【概要】
マクロファージ(Mφ)は全身の組織に分布し、組織恒常性維持や感染防御に重要な役割を担っています。近年の研究により、様々な炎症性疾患の病巣には特殊なMφ集団(疾患関連Mφ)が出現することが明らかになってきました。造血幹細胞からMφへの分化には、CSF1受容体やCSF2受容体の刺激が必要であることが広く認識されていますが、我々は、ある種の脂質のみでマウス骨髄細胞を刺激することで、CSF1受容体やCSF2受容体の刺激を必要としない未知の経路でMφが誘導される事を発見し、このMφをLipid-induced macrophage (LIM)と命名しました。現在、LIMの分化メカニズムや機能、疾患との関連や治療への応用について研究をおこなっています。
④神経-免疫関連による痒みの制御
【概要】
「痒み」は「掻破(引っ掻くこと)したくなるような不快な感覚」と定義されますが、「皮膚を掻く」ことで潜在的に有害な生物(虫など)や物質(かぶれを起こす『漆』など)を皮膚から除去するという観点では生体防御反応の一種だと考えられます。痒みは、皮膚で産生されるヒスタミンなど何らかの物質が、皮膚に投射している末梢の感覚神経によって受容され、そのシグナルが最終的に脳へ到達することで「痒み」として知覚されます。花粉症や蕁麻疹に伴う痒みはヒスタミンが主要なメディエーターだと考えられていて、ヒスタミン受容体の働きを抑えることで、痒みを抑えることができます。一方で、アトピー性皮膚炎などの疾患に伴う痒みはヒスタミン受容体の阻害では効果を示さないことが多く、このような患者さんたちは、「痒み」によって「夜眠れない」、「勉強や仕事に集中できない」といった苦痛に悩まされることになります。近年、主に免疫系で働くと考えられてきたサイトカインという物質が、神経系にも作用し痒みの制御にも関係することが明らかとなってきました。私たちは、これらサイトカインの痒みにおける役割に注目して日々研究を続けています。
⑤免疫抑制性好酸球による食物アレルギーの制御
【概要】
好酸球は自然免疫系に属する白血球であり、寄生虫感染やアレルギー疾患などの2型免疫御応答を促進します。最近、私たちは抑制性C型レクチンレセプターClec4a4を発現する免疫細胞の探索から、2型免疫応答を抑制するClec4a4+好酸球を発見しました(Wang*, Kasamatsu* et al., Proc Natl Acad Sci U S A., 2022. *共同筆頭著者)。Clec4a4+好酸球は芳香族炭化水素受容体(AHR)を高発現しており、AHR依存的にClec4a4+好酸球の分化が促進されます。好酸球特異的にAhrを欠損させたClec4a4+好酸球欠損マウスでは腸管寄生虫排除や2型免疫応答が促進することから、Clec4a4+好酸球が寄生虫免疫応答を負に制御していることが明らかになりました。現在、食物アレルギーモデルを用いて本好酸球の機能解明や食物アレルギー予防・治療法の開発をおこなっています。
スタッフ

教授
より詳細な研究者情報はこちらへ(researchmap)
研究一直線(鹿児島大学)
研究者インタビュー(一般財団法人 化血研)
| 氏名 | 原博満 Hiromitsu HARA |
|---|---|
| 専門分野 | 免疫学 |
| 研究テーマ | ・リンパ球の活性化と増殖・発癌機構 ・自然免疫の活性化と各種疾患発症の関連 |

講師
より詳細な研究者情報はこちらへ(researchmap)
| 氏名 | 坂田大治 Daiji SAKATA |
|---|---|
| 専門分野 | 神経免疫学、薬理学 |
| 研究テーマ | ・病態における痒みの伝達機構の解明 ・病態での神経-免疫相互作用の解析 |

講師
より詳細な研究者情報はこちらへ(researchmap)
研究者インタビュー(一般財団法人 化血研)
| 氏名 | 笠松純 Jun Kasamatsu |
|---|---|
| 専門分野 | 免疫学、免疫遺伝学、比較免疫学 |
| 研究テーマ | ・粘膜組織における免疫応答の解明 ・免疫系の進化・多様性に関する研究 |

助教
より詳細な研究者情報はこちらへ(researchmap)
| 氏名 | 松本信英 Shin-Ei MATSUMOTO |
|---|---|
| 専門分野 | 神経学、神経免疫学 |
| 研究テーマ | ・タウ蛋白の翻訳後修飾・凝集・伝播と認知症 ・神経変性疾患における免疫系の寄与 |
主な研究実績
原博満
- Mitsuyama H, Iizasa E, Kukita A, Toda S, Yoshida H, Inoue H, and Hara H: Deletion of Card9 eliminates the detrimental facets of mycobacterial adjuvants.
Heliyon. 2024, 10(19):e38139. - Iizasa E, Chuma Y, Uematsu T, Kubota M, Kawaguchi H, Umemura M, Toyonaga K, Kiyohara H, Yano I, Colonna M, Sugita M, Matsuzaki G, Yamasaki S, Yoshida H and Hara H: TREM2 is a receptor for non-glycosylated mycolic acids of mycobacteria that limits anti-mycobacterial macrophage activation.
Nat Commun. 2021, 12(1):2299. - Kimura D, Miyakoda K, Kimura K, Honma K, Hara H, Yoshida H, and Yui K: IL-27-producing CD4+ T cells regulate protective immunity during infection with malaria parasites.
Immunity. 2016, 44:672-682. - Uematsu T, Iizasa E-I, Kobayashi N, Yoshida H and Hara H: Loss of CARD9-mediated innate activation attenuates severe influenza pneumonia without compromising host viral immunity.
Sci Rep. 2015, 5:1757. - Hara H, Yokosuka T, Hirakawa H, Ishihara C, Yasukawa S, Yamazaki M, Koseki H, Yoshida H and Saito T: Clustering of CARMA1 through SH3-GUK domain interactions is required for its activation of NF-κB signaling.
Nat Commun. 2015, 6:5555. - Yasukawa S, Miyazaki Y, Yoshii C, Nakaya M, Ozaki N, Toda S, Kuroda E, Ishibashi K-I, Yasuda T, Natsuaki Y, Mi-ichi F, Iizasa EI, Nakahara T, Yamazaki M, Kabashima K, Iwakura Y, Takai T, Saito T, Kurosaki T, Malissen B, Ohno N, Furue M, Yoshida H, and Hara H: An ITAM-Syk-CARD9 signaling axis triggers contact hypersensitivity by stimulating IL-1 production in dendritic cells.
Nat Commun. 2014, 5:3755. - Hara H and Saito T: CARD9 vs. CARMA1 in innate and adaptive immunity.
Trends in immunol. 2009, 30(5): 234-242. - Hara H, Ishihara C, Takeuchi A, Xue L, Morris SW, Penninger JM, Yoshida H, Saito T: Cell-type-specific regulation of ITAM-mediated NF-κB activation by adaptors CARMA1 and CARD9.
J Immunol. 2008, 181(2):918-30. - Hara H, Ishihara C, Takeuchi A, Imanishi1 T, Xue L, Morris SW, Inui M, Takai T, Shibuya A, Saijo S, Iwakura Y, Ohno N, Koseki H, Yoshida H, Penninger JM & Saito T: The adaptor protein CARD9 is essential for the activation of myeloid cells through ITAM-associated and Toll-like receptors.
Nat Immunol. 2007, 8(6):619-29. - Suzuki N, Suzuki S, Millar DG, Unno M, Hara H, Calzascia T, Yamasaki S, Yokosuka T, Chen NJ, Elford AR, Suzuki J, Takeuchi A, Mirtsos C, Bouchard D, Ohashi PS, Yeh WC, Saito T: A critical role for the innate immune signaling molecule IRAK-4 in T cell activation.
Science. 2006 Mar 31;311(5769):1927-32 - Hara H, Bakal C, Wada T, Bouchard D, Rottapel R, Saito T, Penninger JM: The molecular adapter Carma1 controls entry of IκB kinase into the central immune synapse.
J Exp Med. 2004, 200(9):1167-77. - Hara H, Wada T, Bakal C, Kozieradzki I, Suzuki S, Suzuki N, Nghiem M, Griffiths EK, Krawczyk C, Bauer B, D'Acquisto F, Ghosh S, Yeh WC, Baier G, Rottapel R, Penninger JM: The MAGUK family protein CARD11 is essential for lymphocyte activation.
Immunity. 2003, 18(6):763-75. - Hara H, Takeda A, Takeuchi M, Wakeham AC, Itie A, Sasaki M, Mak TW, Yoshimura A, Nomoto K, Yoshida H: The apoptotic protease-activating factor 1-mediated pathway of apoptosis is dispensable for negative selection of thymocytes.
J Immunol. 2002, 168(5):2288-95. - Hara H, Kishihara K, Matsuzaki G, Takimoto H, Tsukiyama T, Tigelaar RE and Nomoto K: Development of dendritic epidermal T cells with a skewed diversity of gamma delta TCRs in Vd1-deficient mice.
J Immunol. 2000, 165(7):3695-705.
和文総説
- 原博満:結核菌による宿主自然免疫応答の制御。
生化学95(5):1-5 (2023). - 原博満:アレルギー性接触皮膚炎感作にかかわる自然免疫活性化機構.
日本皮膚免疫アレルギー学会雑誌. 2(2) : 272-280 (2019) -
原博満:CBMシグナリングの異常によるリンパ球恒常性の破綻と疾患の発症。
実験医学(増刊)「臓器連関による生体恒常性に破綻と疾患」(羊土社)37 (7): 1118-1126 (2019). -
豊永憲司、飯笹英一、原博満:ITAM/ITIM共役受容体によるパターン認識と自然免疫応答。
臨床免疫・アレルギー科 66 (3):274-282 (2016) . -
原博満:Carma1クラスターによる抗原受容体シグナルの制御。
臨床免疫・アレルギー科 64(4):398-403 (2015) -
原博満、安川晋輔:接触アレルゲンによる自然免疫活性化機構。
感染炎症免疫 43 (4):285-95 (2013). -
原博満:CARMA1,BCL10,CARD9とNF-κBの活性化。
臨床免疫・アレルギー科 54(3):378-383 (2010) . -
原博満:CARMA1(CARD11)によるNK細胞活性化の制御。
臨床免疫・アレルギー科 53 (2): 133-139 (2010). -
原博満:リンパ系細胞と骨髄系細胞におけるNF-kB活性化,MAPK活性化誘導アダプターの相違。
臨床免疫・アレルギー科 49(3): 357-364 (2008). -
原博満:抗原レセプターを介したNF-kB活性化経路。
実験医学 23:2052-2056(2005)
坂田大治
- Kunimura K, Akiyoshi S, Uruno T, Matsubara K, Sakata D, Morino K, Hirotani K, Fukui Y: DOCK2 regulates MRGPRX2/B2-mediated mast cell degranulation and drug-induced anaphylaxis.
J Allergy Clin Immunol., 151(6), 1585-1594.e9, 2023. - Morino K, Kunimura K, Sugiura Y, Izumi Y, Matsubara K, Akiyoshi S, Maeda R, Hirotani K, Sakata D, Mizuno S, Takahashi S, Bamba T, Uruno T, Fukui Y: Cholesterol sulfate limits neutrophil recruitment and gut inflammation during mucosal injury.
Front Immunol., 17;14:1131146, 2023. - Tatsuguchi T, Uruno T, Sugiura Y, Oisaki K, Takaya D, Sakata D, Izumi Y, Togo T, Hattori Y, Kunimura K, Sakurai T, Honma T, Bamba T, Nakamura M, Kanai M, Suematsu M, Fukui Y: Pharmacological intervention of cholesterol sulfate-mediated T cell exclusion promotes antitumor immunity.
Biochem Biophys Res Commun., 18;609:183-188, 2022. - Tatsuguchi T, Uruno T, Sugiura Y, Sakata D, Izumi Y, Sakurai T, Hattori Y, Oki E, Kubota N, Nishimoto K, Oyama M, Kunimura K, Ohki T, Bamba T, Tahara H, Sakamoto M, Nakamura M, Suematsu M, Fukui Y: Cancer-derived cholesterol sulfate is a key mediator to prevent tumor infiltration by effector T cells.
Int Immunol., 34(5), 277-289, 2022. - Matsubara K, Kunimura K, Yamane N, Aihara R, Sakurai T, Sakata D, Uruno T, Fukui Y: DOCK8 deficiency causes a skewing to type 2 immunity in the gut with expansion of group 2 innate lymphoid cells.
Biochem Biophys Res Commun., 24;559:135-140, 2021. - Kamikaseda Y, Uruno T, Kunimura K, Harada A, Saiki K, Oisaki K, Sakata D, Nakahara T, Kido-Nakahara M, Kanai M, Nakamura S, Ohkawa Y, Furue M, Fukui Y: Targeted inhibition of EPAS1-driven IL-31 production by a small-molecule compound.
J Allergy Clin Immunol., 148(2):633-638, 2021. - Sakurai T, Kukimoto-Miino M, Kunimura K, Yamane N, Sakata D, Aihara R, Yasuda T, Yokoyama S, Shirozu M, Fukui Y, Uruno T, Furue M, Fukui Y: A conserved PI(4, 5)P2-binding domain is critical for immune regulatory function of DOCK8.
Life Sci. Alliance., 11;4(4):e202000873, 2021. - Aihara R, Kunimura K, Watanabe M, Uruno T, Yamane N, Sakurai T, Sakata D, Nishimura F, Fukui Y: DOCK8 controls survival of group 3 innate lymphoid cells in the gut through Cdc42 activation.
Int Immunol., 1;33(3):149-160, 2020. - Kunimura K, Sakata D, Tun X, Uruno T, Ushijima M, Katakai T, Shiraishi A, Aihara R, Kamikaseda Y, Matsubara K, Kanegane H, Sawa S, Eberl G, Ohga S, Yoshikai Y, Fukui Y: S100A Protein Is Essential for the Development of Mature Microfold Cells in Peyer’s Patches.
Cell Rep., 29(9), 2823-2834.e7, 2019. - Sakata D, Uruno T, Matsubara K, Andoh T, Yamamura K, Magoshi Y, Kunimura K, Kamikaseda Y, Furue M, Fukui Y: Selective role of neurokinin B in IL-31-induced itch response in mice.
J Allergy Clin Immunol., 144(4), 1130-1133.e8, 2019.
笠松純
- Wang WL*, Kasamatsu J*, Joshita S*, Gilfillan S, Di Luccia B, Panda SK, Kim DH, Desai P, Bando JK, Huang SC, Yomogida K, Hoshino H, Fukushima M, Jacobsen EA, Van Dyken SJ, Ruedl C, Cella M, Colonna M (*共同筆頭著者): The aryl hydrocarbon receptor instructs the immunomodulatory profile of a subset of Clec4a4+ eosinophils unique to the small intestine.
Proc Natl Acad Sci U S A., 7;119(23):e2204557119, 2022. - Tashiro R, Niizuma K, Kasamatsu J, Okuyama Y, Rashad S, Kikuchi A, Fujimura M, Kure S, Ishii N, Tominaga T: Dysregulation of Rnf 213 gene contributes to T cell response via antigen uptake, processing, and presentation.
J Cell Physiol., 236(11):7554-7564, 2021. - Sato K, Yamamoto H, Nomura T, Kasamatsu J, Miyasaka T, Tanno D, Matsumoto I, Kagesawa T, Miyahara A, Zong T, Oniyama A, Kawamura K, Yokoyama R, Kitai Y, Ishizuka S, Kanno E, Tanno H, Suda H, Morita M, Yamamoto M, Iwakura Y, Ishii K, Kawakami K: Production of IL-17A at Innate Immune Phase Leads to Decreased Th1 Immune Response and Attenuated Host Defense against Infection with Cryptococcus deneoformans.
J Immunol., 1;205(3):686-698, 2020. - Kasamatsu J, Deng M, Azuma M, Funami K, Shime H, Oshiumi H, Matsumoto M, Kasahara M, Seya T: Double-stranded RNA analog and type I interferon regulate expression of Trem paired receptors in murine myeloid cells.
BMC Immunol., 3;17(1):9, 2016. - Kasamatsu J, Takahashi S, Azuma M, Matsumoto M, Morii-Sakai A, Imamura M, Teshima T, Takahashi A, Hirohashi Y, Torigoe T, Sato N, Seya T. PolyI:C and mouse survivin artificially embedding human 2B peptide induce a CD4+ T cell response to autologous survivin in HLA-A*2402 transgenic mice.
Immunobiology, 220(1):74-82, 2015 - Kasamatsu J, Azuma M, Oshiumi H, Morioka Y, Okabe M, Ebihara T, Matsumoto M, Seya T: INAM plays a critical role in IFN-γ production by NK cells interacting with polyinosinic-polycytidylic acid-stimulated accessory cells.
J Immunol., 15;193(10):5199-207, 2014. - Kanda R, Sutoh Y, Kasamatsu J, Maenaka K, Kasahara M, Ose T: Crystal structure of the lamprey variable lymphocyte receptor C reveals an unusual feature in its N-terminal capping module.
PLoS One, 23;9(1):e85875, 2014. - Kasamatsu J: Evolution of innate and adaptive immune systems in jawless vertebrates.
Microbiol Immunol., 57(1):1-12, 2013. - Ebihara T, Azuma M, Oshiumi H, Kasamatsu J, Iwabuchi K, Matsumoto K, Saito H, Taniguchi T, Matsumoto M, Seya T: Identification of a polyI:C-inducible membrane protein that participates in dendritic cell-mediated natural killer cell activation.
J Exp Med., 22;207(12):2675-87, 2010. - Kasamatsu J*, Sutoh Y*, Fugo K, Otsuka N, Iwabuchi K, Kasahara M (*共同筆頭著者): Identification of a third variable lymphocyte receptor in the lamprey.
Proc Natl Acad Sci U S A., 10;107(32):14304-8, 2010. - Kasamatsu J, Oshiumi H, Matsumoto M, Kasahara M, Seya T: Phylogenetic and expression analysis of lamprey toll-like receptors.
Dev Comp Immunol., 34(8):855-65, 2010. - Kasamatsu J, Suzuki T, Ishijima J, Matsuda Y, Kasahara M: Two variable lymphocyte receptor genes of the inshore hagfish are located far apart on the same chromosome.
Immunogenetics, 59(4):329-31, 2007. - Kim HM, Oh SC, Lim KJ, Kasamatsu J, Heo JY, Park BS, Lee H, Yoo OJ, Kasahara M, Lee JO: Structural diversity of the hagfish variable lymphocyte receptors.
J Biol Chem., 2;282(9):6726-32, 2007. - Pancer Z, Saha NR, Kasamatsu J, Suzuki T, Amemiya CT, Kasahara M, Cooper MD: Variable lymphocyte receptors in hagfish.
Proc Natl Acad Sci U S A., 28;102(26):9224-9, 2005. - Kasamatsu J, Watanabe Y, Hanzawa N: Genetic Variability of MHC Class II Beta 1 Genes in Far Eastern Dace,Tribolodon hakonensis.
Mar Biotechnol., 6 S398-S403, 2004.
和文総説
- 笠松 純, 川上 和義: クリプトコックス感染における防御免疫応答とその破綻。
日本医真菌学会雑誌 63(3) 47-58, 2022. - 笠松 純, 瀬谷 司, 笠原 正典: 病原体認識戦略の進化。
臨床免疫・アレルギー科, 56(1), 113-121, 2010. - 笠松 純, 笠原 正典: 高次機能形成の比較ゲノム:抗原認識戦略の多様性 -免疫系の比較ゲノム解析から学ぶ-。
比較ゲノム学から読み解く生命システム 基本概念から最新ゲノム情報まで, 87-96, 2007. - 笠松 純, 笠原 正典: Variable lymphocyte receptorの構造と機能。
Annual Review 免疫 2007, 53-61, 中外医学社, 2006. - 笠松 純, 笠原 正典: 高次機能形成の比較ゲノム:適応免疫系の起源と多様性.
細胞工学, 25(3), 298-303, 2006.
松本信英
- Eriko Kuramoto, Ayano Kitawaki, Takakazu Yagi, Hiroshi Kono, Shin-Ei Matsumoto, Hiromitsu Hara, Yasumasa Ohyagi, Haruki Iwai, Atsushi Yamanaka, Tetsuya Goto: Development of a system to analyze oral frailty associated with Alzheimer's disease using a mouse model.
Frontiers in Aging Neuroscience 14:935033 (2022) - Tsukasa Fujiki, Shin-Ei Matsumoto, Yoshinori Katakura: Age-related functional decline of human B cells.
Cytotechnology 74(2): 319-327 (2022) - Tetsuo Hayashi, Shotaro Shimonaka, Montasir Elahi, Shin-Ei Matsumoto, Koichi Ishiguro, Masashi Takahashi, Nobutaka Hattori, Yumiko Motoi: Learning Deficits Accompanied by Microglial Proliferation After the Long-Term Post-Injection of Alzheimer's Disease Brain Extract in Mouse Brains.
Journal of Alzheimer’s Disease 79: 1701-1711 (2021) - Shotaro Shimonaka, Shin-Ei Matsumoto, Montasir Elahi, Koichi Ishiguro, Masato Hasegawa, Nobutaka Hattori, Yumiko Motoi: Asparagine residue 368 is involved in Alzheimer’s disease tau strain-specific aggregation.
Journal of Biological Chemistry 295(41): 13996-14014 (2020) - Tetsuya Goto, Eriko Kuramoto, Ashis Dhar, Rachel P-H Wang, Haruka Seki, Haruki Iwai, Atsushi Yamanaka, Shin-Ei Matsumoto, Hiromitsu Hara, Makoto Michikawa, Yasumasa Oyagi, Wai K Leung, Raymond C-C Chang: Neurodegeneration of Trigeminal Mesencephalic Neurons by the Tooth Loss Triggers the Progression of Alzheimer’s Disease in 3xTg-AD Model Mice.
Journal of Alzheimer’s Disease 76(4):1443-1459 (2020) - Nakayama S, Shimonaka S, Elahi M, Nishioka K, Oji Y, Matsumoto SE, Li Y, Yoshino H, Mogushi K, Hatano T, Sato T, Ikura T, Ito N, Motoi Y, Hattori N: Tau aggregation and seeding analyses of two novel MAPT variants found in patients with motor neuron disease and progressive parkinsonism.
Neurobiology of aging 2019, 84: 240.e13-240.e22 - Yuko Hara,Yumiko Motoi,Keigo Hikishima,Hiroshi Mizuma,Hirotaka Onoe,Shin-Ei Matsumoto,Montasir Elahi,Hideyuki Okano,Shigeki Aoki,Nobutaka Hattori: Involvement of the Septo-Hippocampal Cholinergic Pathway in Association with Septal Acetylcholinesterase Upregulation in a Mouse Model of Tauopathy
CURRENT ALZHEIMER RESEARCH 14(1) 94-103 2017 - Montasir Elahi, Zafrul Hassan, Yumiko Motoi, Shin-Ei Matsumoto, Koichi Ishiguro, and Nobutaka Hattori: Region-specific vulnerability to oxidative stress, neuroinflammation, and tau hyperphosphorylation in experimental diabetes mellitus mice.
J Alzheimers Dis. 2016, 51(4) 1209-1224 - Montasir Elahi, Yumiko Motoi, Shin-Ei Matsumoto, Zafrul Hassan, Koichi Ishiguro, and Nobutaka Hattori: Short-term treadmill exercise increased tau insolubility and neuroinflammation in tauopathy model mice
Neurosci Lett. 2016, 610: 207-212 - Shin-Ei Matsumoto, Yumiko Motoi, Koichi Ishiguro, Takeshi Tabira, Fuyuki Kametani, Masato Hasegawa, and Nobutaka Hattori: The twenty-four KDa C-terminal tau fragment increases with aging in tauopathy mice: implications of prion-like properties.
Hum Mol Genet. 2015, 24(22): 6403-6416 - Kosuke Tomimatsu, Shin-Ei Matsumoto, Hayato Tanaka, Makiko Yamashita, Hidekazu Nakanishi, Kiichiro Teruya, Saiko Kazuno, Tomoya Kinjo, Takeki Hamasaki, Ken-ichi Kusumoto, Shigeru Kabayama, Yoshinori Katakura and Sanetaka Shirahata: A rapid screening and production method using a novel mammalian cell display to isolate human monoclonal antibodies.
Biochem Biophys Res Commun. 2013, 441(1): 59-64 - Gakuro Harada, Shin-Ei Matsumoto, Makiko Yamashita, Kaoru Fujii, Sanetaka Shirahata and Yoshinori Katakura: In vitro immunization of Epstein-Barr virus-immortalized B cells augments antigen-specific antibody production.
Cytotechnology. 2013, 65(6): 979-983 - Satomi Shiota, Hidenori Takekawa, Shin-Ei Matsumoto, Kazuya Takeda, Fariz Nurwidya, Yasuko Yoshioka, Fumiaki Takahashi, Nobutaka Hattori, Takeshi Tabira, Hideki Mochizuki and Kazuhisa Takahashi: Chronic Intermittent Hypoxia/Reoxygenation Facilitate Amyloid-β Generation in Mice.
J Alzheimers Dis. 2013, 37(2): 325-333 - Kohei Shimada, Yumiko Motoi, Koichi Ishiguro, Taiki Kambe, Shin-Ei Matsumoto, Masako Itaya, Miyuki Kunichika, Hideo Mori, Atsuko Shinohara, Momoko Chiba, Yoshikuni Mizuno, Takashi Ueno, and Nobutaka Hattori: Long-term oral lithium treatment attenuates motor disturbance in tauopathy model mice: Implications of autophagy promotion.
Neurobiol Dis. 2012, 46(1): 101-108 - Tohru Hasegawa, Masayoshi Ichiba, Shin-Ei Matsumoto, Koji Kasanuki, Taku Hatano, Hiroshige Fujishiro, Eizo Iseki, Nobutaka Hattori, Tatsuo Yamada, and Takeshi Tabira: Urinary homocysteic acid levels correlate with mini-mental state examination scores in Alzheimer’s disease patients.
J Alzheimers Dis. 2012, 31(1): 59-64
主な特許等(出願中も含む)
| 名称 / 特許番号等 | 発明者等 |
|---|---|
| マクロファージの製造方法 特許第7452918号 |
原博満、松本信英、豊永憲司 令和6年3月11日 |
| 掻痒治療剤 特許第7382625号 |
原博満、野元祐輔、金蔵拓郎 椛島健治、中嶋千紗 令和1年8月29日 |
| ノックアウト非ヒト化動物 特許第6187985号 |
野出孝一、吉田裕樹、原博満 平瀬徹明、宮崎義之 平成27年7月24日 |
| ノックアウト非ヒト化動物 特許第5822248号 |
野出孝一、吉田裕樹、原博満 平瀬徹明、宮崎義之 平成21年10月27日 |
| NK細胞の機能調節剤およびそのスクリーニング法 特開2008-118862 |
齋藤隆、原博満 平成18年11月8日 |
共同研究・開発
- インフルエンザウイルスと内因性リガンドを認識する新規自然免疫受容体の解析(北里研究所)
- 結核菌の免疫回避機構の解明(国立感染症研究所、琉球大学)
- ハンセン病の神経障害機構の解明(国立感染症研究所)
- CARD11遺伝子変異に基づくアトピー性皮膚炎の病態・臨床像の解明(筑波大学)
人材募集
当分野は免疫学に興味のある人材を広く受け入れています.お気軽に問合せ下さい!
連絡先:meneki(@)m.kufm.kagoshima-u.ac.jp(事務担当:上村さん)
●免疫学に興味のある医学部生へ
免疫異常は多種多様な疾患に関与しています。免疫学に興味のある医学科の学生を対象に、自主研生(自主研究 A~F)を随時募集しています。医療サービス(医師)と基礎研究(科学者)を使いこなすPhysician scientistを目指してみませんか?免疫学分野では、研究活動を通して基礎研究の考え方から実験や学会発表まで、皆さんをサポートします!
保健学科の学生も受け入れています。過去には、看護学専攻や理学療法学専攻の学生を対象に、研究体験をおこないました。免疫学に興味のある方は気軽に問い合わせて下さい!将来、各種研究職(大学や企業)や製薬会社への就職に興味のある学生にもおススメです。
●免疫学に興味のある他学部生へ
医学部生だけではなく、免疫学に興味のある他学部生も随時募集しています。医学部と言っても、基礎系の研究室は他学部の研究室と雰囲気は変わりません。研究経験や免疫学の基礎知識が無くてもOKです!これまで、学部1~2年生を対象に、夏休みを利用した研究体験も受け入れてきました。まず、簡単な研究紹介とラボツアーをおこないます。興味のある研究があれば、是非一緒にサイエンスを楽しみましょう!継続的に研究することも可能です。
●大学院進学を考えている皆様へ (入試案内はこちらから。)
当分野のスタッフは農学部や基礎工学部、理学部出身者から構成されています。医学部だけではなく、他学部から大学院進学をお考えの方は、ぜひお気軽にお問い合わせください。最新の研究データをお示ししながら、当研究室のプロジェクトを紹介します。
修士課程への進学者には、研究活動を通じて免疫学への興味を喚起すると共に、論理的思考力の育成を目指します。Ph.Dコースに進む研究者候補生だけではなく、様々な職種で自主的・論理的に行動できる人材を育成します。医学の知識や様々な実験手技も習得できるため、企業研究者を志向する学生にもおススメです。
Ph.Dコースへの進学者には、厳しいサイエンスの世界で生き残るために必要なスキル(知識・技術・発想力・集金力など)を習得してもらい、自主的に行動できる研究者育成を目指します。研究発信力の向上を目的に、学会や研究会へ積極的に参加してもらいます。また、研究費獲得能力を向上するために日本学術振興会特別研究員(DC1・2)への申請も推奨します(もちろん、研究費申請書の書き方や添削などのサポートをします)。また、スタッフには留学経験者も多く、将来的に研究留学を考えている学生もサポートします。
●最新の免疫学研究に興味のある皆様へ
最新の論文を紹介するジャーナルクラブ(JC)も隔週火曜日(18:00~)におこなっています。興味のある方はお気軽に御参加ください。聴講のみの参加も歓迎しています。参加希望の方は下記連絡先まで御連絡下さい。
主な研究費取得状況
原博満
| 事業・種目 / 期間 | 研究 |
|---|---|
| 基盤研究(B) 令和5〜7年度 |
TREM2を介したマクロファージの許容的分化と機能調節機構の解明 |
| 内藤記念科学振興財団 研究助成 令和5年度 |
新規マクロファージプラットフォームを用いた免疫細胞療法の開発 |
| 化学及血清療法研究所 研究助成 令和4~7年度 |
結核菌による許容的マクロファージ誘導と潜伏持続感染機構の解明 |
| 上原記念生命科学財団研究助成金 令和3年度 | 結核菌の免疫制御と長期潜伏感染機構の解明 |
| ノバルティス研究奨励金 令和3年度 |
神経-免疫連関による痒み抑制機構の解明 |
| 基盤研究(C) 令和2〜4年度 |
抗酸菌病原性脂質の宿主認識と免疫制御機構の解明 |
| 挑戦的研究(萌芽) 平成29〜30年度 |
骨髄系ITAM受容体を利用した新規感作性化合物試験法の開発の基盤研究 |
| 基盤研究(B) 平成27~29年度 |
脂質センサー型ITAM受容体による抗酸菌特異的脂質の認識と結核病態の制御 |
| 挑戦的萌芽研究 平成27~28年度 |
アレルギー性化合物を認識する自然免疫受容体の探索 |
| コスメトロジー研究振興財団研究助成 平成30年度 |
アレルギー性化合物を感知する自然免疫受容体の同定とそれを利用した感作抗原性評価系の樹立 |
| 上原記念生命科学財団研究助成金 平成29年度 | 脂質パターン認識受容体を介した結核菌の免疫回避機構 |
| 児玉記念基礎医学研究助成 新研究プロジェクトスタートアップ支援助成 平成29〜30年度 |
ITAM共役パターン認識受容体による抗酸菌脂質の認識と免疫応答制御機構の解析 |
| 武田科学振興財団 特定研究助成 平成28年度 | 感染症克服の新機軸としてのITAM/ITIM関連パターン認識受容体研究 |
| 児玉記念基礎医学研究助成 新研究プロジェクトスタートアップ支援助成 平成29〜30年度 |
ITAM共役パターン認識受容体による抗酸菌脂質の認識と免疫応答制御機構の解析 |
| ノバルティス研究奨励金 平成27年度 |
結核菌の病原性脂質を認識する自然免疫受容体を介した宿主免疫の制御機構 |
| 内藤記念科学振興財団 研究助成金 平成27年度 |
結核菌表層の病原性脂質を認識する自然免疫受容体の機能解析 |
| 中辻創智社 研究会議開催費助成 平成30年度 |
免疫サマースクール2018 |
| 児玉記念基礎医学研究助成 会議開催助成 平成30年度 |
ITAMワークショップ |
| アステラス病態代謝研究会 研究助成金 平成27年度 |
結核菌表層の病原性脂質による自然免疫応答の制御機構 |
坂田大治
| 事業・種目 / 期間 | 研究 |
|---|---|
| 基盤研究(C) 令和5〜8年度 |
抑制性サイトカインIL-27による痒み抑制メカニズムの解明 |
| 基盤研究(C) 令和2〜5年度 |
ミクログリアに着目したライフスパン縦断的神経免疫反応におけるDOCK2の機能解析 |
| 基盤研究(C) 平成27〜30年度 |
神経免疫炎症における異物除去蛋白質AIMの役割の解析 |
| 若手研究(A) 平成22年度 |
腫瘍免疫におけるプロスタノイド受容体の役割の解析 |
| 若手研究(B) 平成20〜22年度 |
リンパ球におけるmDiaファミリー蛋白質の包括的機能解析 |
笠松純
| 事業・種目 / 期間 | 研究 |
|---|---|
| 武田科学振興財団 医学系研究助成 令和5~9年度 |
食物アレルギーにおける新規腸管好酸球サブセットの機能解明とその応 |
| 内藤記念科学振興財団 研究助成 令和5年度 |
食物アレルギーにおける新規好酸球サブセットの機能解明とその応用 |
| 基盤研究(C) 令和5~7年度 |
新規免疫抑制分子Plet-1の機能解析と革新的なARDS治療薬の開発 |
| 化学及血清療法研究所 化血研若手研究奨励助成 令和5~7年度 |
食物アレルギーにおける新規腸管好酸球サブセットの機能解析とその応用 |
| 児玉記念基礎医学研究助成基金 令和5年度 | 免疫寛容や感染症における新規免疫調節分子Plet-1の機能解析 |
| BioLegend LEGEND Research Grant Program 2022(後期)令和5年度 | 食物アレルギーにおける新規免疫抑制型好酸球サブセットの機能と免疫抑制機構の解明 |
| 第一三共生命科学研究振興財団 海外留学奨学助成 平成27~29年度 |
自然リンパ球と適応免疫系の機能連携に関する研究 |
| 伊藤医薬学術交流財団 海外留学研究交流助成 平成27年度 |
自然リンパ球の機能とその炎症性疾患・感染・発がんへの関与 |
| 持田記念医学薬学振興財団 海外留学補助金 平成27年度 |
自然リンパ球と適応免疫系の機能連携に関する研究 |
| 内藤記念科学振興財団 海外研究留学助成金 平成26年度 |
自然リンパ球の機能とその炎症性疾患・感染・発がんへの関与 |
| 特別研究員奨励費(PD) 平成23~26年度 |
抗ガン治療の基礎研究 : 樹状細胞によるNK細胞活性化機構の解明 |
| 特別研究員奨励費(DC1) 平成18~21年度 |
無顎脊椎動物を用いたMHC領域の比較ゲノム解析および免疫系の多様性に関する研究 |
松本信英
| 事業・種目 / 期間 | 研究 |
|---|---|
| 基盤研究(C) 令和6年度〜令和8年度 |
コロニー刺激因子受容体非依存的・TREM2依存的な未知のマクロファージ分化機構の解明 |
| 内藤記念科学振興財団 研究助成金 令和2年度 |
脳の脂質により誘導される骨髄由来ミクログリア様細胞の解析 |
| 基盤研究(C) 平成31〜令和3年度 |
凝集タウの伝播におけるミクログリアの役割の解明 |
| 児玉記念基礎医学研究助成基金 平成31年度 |
神経変性疾患のタンパク凝集体伝播におけるミクログリアの役割 |
| 新潟大学脳研究所共同研究費補助金 平成31年度〜令和2年度 |
タウ凝集体の伝播におけるミクログリアの役割 |
| 新潟大学脳研究所共同研究費補助金 平成29年度 |
アルツハイマー病の病態におけるタウC末端断片の役割の解明 |
| 児玉記念基礎医学研究助成基金 平成28年度 |
タウの凝集・伝播における自然免疫受容体TREM2の役割の解析 |
| 基盤研究(C) 平成28〜30年度 |
タウオパチー伝播モデルを用いたアルツハイマー病危険因子の役割の解明 |
















