Ethics Committee on Epidemiological Studies, Kagoshima University
はじめに
令和3年6月30日付で「人を対象とする医学系研究に関する倫理指針」及び「ヒトゲノム・遺伝子解析研究に関する倫理指針」が廃止され、「人を対象とする生命科学・医学系研究に関する倫理指針」に一本化されました。
これにともない各指針に対応して本学桜ヶ丘地区にて制定されていた倫理規則と、倫理審査にかかる委員会を見直し、「鹿児島大学桜ヶ丘地区における人を対象とする生命科学・医学系研究に関する倫理規則」として令和3年7月14日から施行(令和3年6月30日から適用)しました。
この規則のもとに、新たに「鹿児島大学桜ヶ丘地区臨床研究倫理委員会」「鹿児島大学桜ヶ丘地区疫学研究等倫理委員会」の2つの倫理委員会が設置されました。
本ページでは、上記の内「鹿児島大学桜ヶ丘地区疫学研究等倫理委員会」の審査対象となる研究課題に関する手続きを掲載しております。
「人を対象とする生命科学・医学系研究に関する倫理指針」に基づき、学内委員及び学外委員により構成されております。
・![]() 鹿児島大学桜ヶ丘地区疫学研究等倫理委員会委員一覧
鹿児島大学桜ヶ丘地区疫学研究等倫理委員会委員一覧
・委員会事務局:医歯学総合研究科等 総務課 研究協力・倫理審査係
(医歯学総合研究科棟1(歯学部棟)2階)
※旧生命倫理・遺伝子解析研究倫理委員会の審査対象課題も含む
※ヒトES細胞に関する研究計画は除く
・![]() 鹿児島大学桜ヶ丘地区における人を対象とする生命科学・医学系研究に関する倫理規則
鹿児島大学桜ヶ丘地区における人を対象とする生命科学・医学系研究に関する倫理規則
・人を対象とする生命科学・医学系研究に関する倫理指針(リンク先:文科省ライフサイエンスの広場)
・![]() ヘルシンキ宣言(人間を対象とする医学系研究の倫理的原則)(リンク先:厚労省HP内)
ヘルシンキ宣言(人間を対象とする医学系研究の倫理的原則)(リンク先:厚労省HP内)
「鹿児島大学桜ヶ丘地区における人を対象とする生命科学・医学系研究に関する倫理規則」に基づき審査される研究課題について、研究の実施体制等により以下の4パターンに審査の形態が分かれます。
審査の申請を希望される方は、各々の研究課題における実施体制や状況等を踏まえて、書類を準備、提出願います。
なお、桜ヶ丘地区において生命科学・医学系研究を実施するにあたっては、大学病院・臨床研究管理センター主催の講習会参加による単位認証が義務付けられております。単位取得についての詳細は以下のページをご参照ください。
・認証教育制度について(大学病院・臨床研究管理センター)
〇審査の形態について
1.新規申請(※本学が単独で行う研究、又は本学が多機関共同研究の代表研究機関となる研究)
2.新規申請(※本学が多機関共同研究の共同研究機関として参画する研究)
3.変更申請(※本学が単独で行う研究、又は本学が多機関共同研究の代表研究機関となる研究)
4.変更申請(※本学が多機関共同研究の共同研究機関として参画する研究)
※詳細は以下をご参照ください。
(※本学が単独で行う研究、又は本学が多機関共同研究の代表研究機関となる研究)
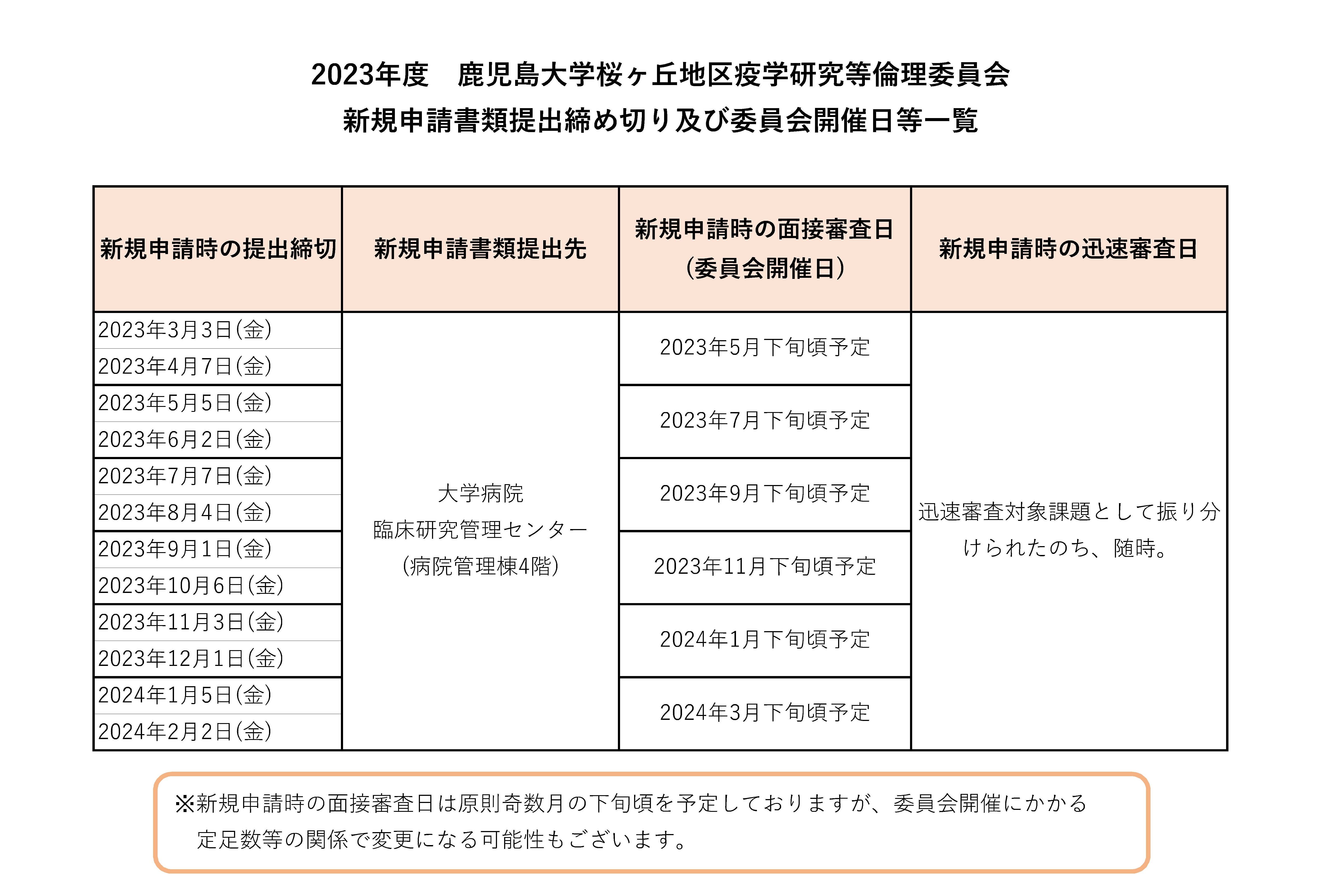
鹿児島大学桜ヶ丘地区疫学研究等倫理委員会は、2023年4月現在、原則奇数月の下旬に開催しています。
新規申請された研究課題は大学病院臨床研究管理センターにて、研究内容に応じて審査を実施する桜ヶ丘地区の二つの委員会に振り分けられます。本委員会における審査対象となった課題については、原則として委員会開催月の前月、前々月分の申請を審査します。
※例えば5月の委員会は3月と4月までの締切分を審査します。
本委員会の審査対象として振り分けられた研究課題の研究責任者には、委員会事務局より審査日時の連絡があります。
また規則により迅速審査となる場合も同様に研究責任者へ連絡があります。
提出締切日、提出先、委員会審査日等は以下をご参照ください。
※〆切は厳守願います。
また、必要書類及び手続きの流れ等は以下をご参照ください。
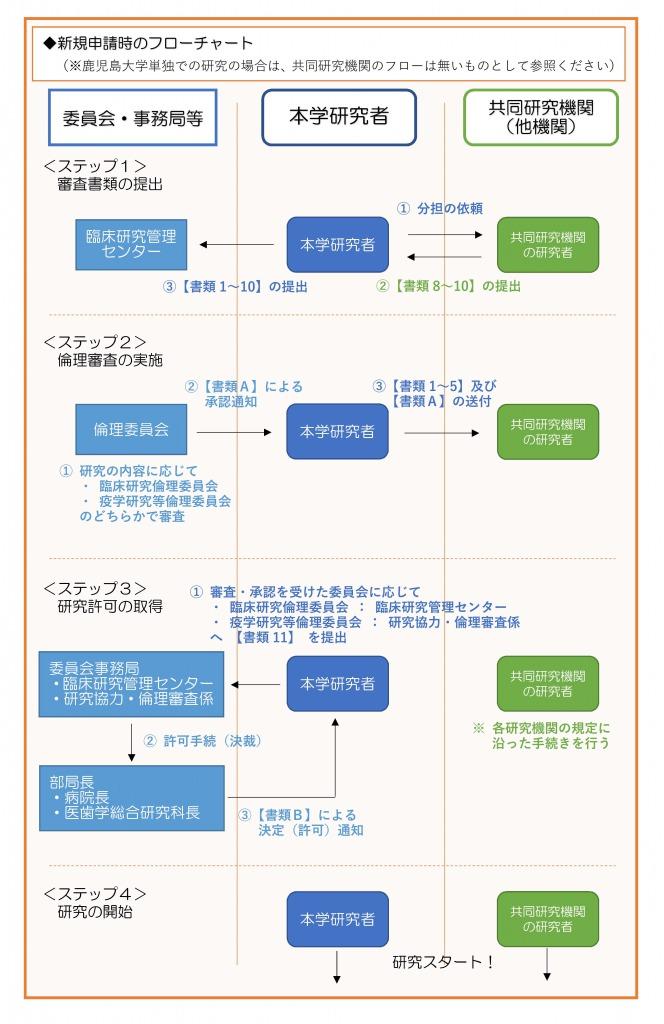
◆研究者が作成する書類(※下記フローチャートの【書類1~11】に対応しております)
※◎印の書類は多機関共同研究の場合のみ作成
1.生命科学・医学系研究倫理審査申請書(新規)★
2.研究者等リスト ★
3.生命科学・医学系研究実施計画書 ★
4.説明文書、同意書、同意撤回通知書 ★
5.情報公開文書 ★
6.他の研究機関への試料・情報の提供に関する届出書 ★
7.審査形態確認書 ★ ◎
8.研究分担機関の確認書【多機関共同研究に参加する研究分担機関用】☆ ◎
9.研究機関要件確認書 ☆ ◎
10.研究者等リスト(多機関共同研究に参加する研究分担機関分)☆ ◎
11.研究実施許可願の申請書 ★
(書類の作成者について)
★印:本学の研究者が作成
☆印:本学が多機関共同研究の代表研究機関として申請を行う際に、共同研究機関の研究者が作成。
(書類作成時の留意事項)
※4、5は研究内容に応じて二者択一で提出、もしくは両方提出。
※6は研究内容に応じて必要な場合のみ提出。
※8、9、10(☆印の書類)は共同研究機関が作成の上、研究代表機関(本学)に提出。
※本学の倫理審査に必要な書類は1~10まで。11は下記Aの書類(審査結果通知書)を受領後に提出。
(書類の提出先)
※1~10の書類:大学病院・臨床研究管理センターへ提出。
※11の書類:審査・承認された委員会の事務局へ提出。
→臨床研究倫理委員会で審査・承認の場合:大学病院・臨床研究管理センター
疫学研究等倫理委員会で審査・承認の場合:医歯学総合研究科等総務課研究協力・倫理審査係
◆倫理委員会(委員会事務局)が作成する書類(※下記フローチャートの【書類A・B】に対応しております)
A.審査結果通知書
B.研究に関する決定通知書
※Aは倫理委員会での承認後、委員会(事務局)で作成し、本学研究者に通知。
※Bは研究者から委員会(事務局)へ上記11の書類(研究実施許可願の申請書)を提出後、部局長の許可(決裁)を経て、本学研究者へ通知。
※以下の画像をクリックしますと別ウインドで開きます。
なお、従来、医学系研究の倫理申請等の書類様式は委員会毎に定めておりましたが、指針の統一と規則の制定にともない令和3年6月30日から「生命科学・医学系研究倫理審査申請書」等に統一することとなりました。
・様式ダウンロード(大学病院 臨床研究管理センターHP)
https://www.hosp.kagoshima-u.ac.jp/department/rinshou-kenkyu/rinsyou-kenkyu-11/#seimei2
※様式は変更等ありますので、都度ダウンロードしてご利用ください。
(※本学が多機関共同研究の共同研究機関となる研究)
令和3年6月30日施行の「人を対象とする生命科学・医学系研究に関する倫理指針」に基づき、多機関共同研究の共同研究機関として参画する研究においては、倫理審査は原則として代表研究機関にて一括で行われることとなりました。代表研究機関からの求めにより各共同研究機関で作成する書類もありますので、代表研究機関の指示に従ってください。
また、代表研究機関における倫理審査承認後、代表研究機関及び全ての共同研究機関は、各研究機関の長から当該研究課題実施の許可を得なければ、研究を実施することができません。
研究実施許可の手続きに係る提出書類等については、以下をご参照ください。
【まずはじめに】※重要!※
多機関共同研究の代表機関から分担機関としての参画の打診があった場合、代表機関での倫理審査に進む前に、まずはじめに本学・大学病院臨床研究管理センターへとご連絡ください。本学が分担機関として参画するにあたっての利益相反管理に係る手続きを行います。
◎大学病院臨床研究管理センター(内線:6624)
E-mail:このメールアドレスはスパムボットから保護されています。閲覧するにはJavaScriptを有効にする必要があります。
◆研究者が作成する書類
1.研究実施許可願の申請書 ★
2.代表機関における倫理審査の結果通知書 ☆
3.代表機関において承認を受けた倫理審査書類一式 ☆
4.他の研究機関への試料・情報の提供に関する届出書 ★
(書類の作成者について)
★印:本学の研究者が作成
☆印:当該多機関共同研究の代表研究機関が作成
(書類作成時の留意事項)
※4は研究内容に応じて必要な場合のみ提出
(書類の提出先)
※大学病院・臨床研究管理センターへ提出。
◆倫理委員会(委員会事務局)が作成する書類
研究に関する決定通知書
※研究者から上記提出先へ書類を提出後、部局長の許可(決裁)を経て、本学研究者へ通知。
なお、令和3年6月29日以前に「人を対象とする医学系研究に関する倫理指針(旧指針)」に基づき代表研究機関で審査された研究課題の場合、代表研究機関の判断により、従前どおり各共同研究機関においても倫理審査を行う場合があります。
多機関共同研究の共同研究機関としての参画を打診されましたら、まずは倫理審査の形態について、代表研究機関における一括審査か、従前どおりの各機関における個別審査か、代表研究機関へご確認ください。
(※本学が単独で行う研究、又は本学が多機関共同研究の代表研究機関となる研究)
変更申請を希望する研究課題の研究責任者は、必要書類一式を委員会事務局(医歯学総合研究科等 総務課 研究協力・倫理審査係(医歯学総合研究科棟1 歯学系 2階))にご提出ください。
締切はありません。随時受け付けております。
必要書類の作成にあたり、前回承認時の内容からの変更箇所については、委員会委員が審査をする上で、どのポイントが変更されたのか一目瞭然となるよう、朱書きの上、下線を付してください。
※旧様式(旧指針のもとに設置されていた各倫理委員会の様式)で承認を受けている場合、新様式で作成しなおした上で、変更箇所は朱書き、下線を付しご提出ください。
提出締切日、提出先、委員会審査日等は以下をご参照ください。

また、必要書類及び手続きの流れ等は以下をご参照ください。
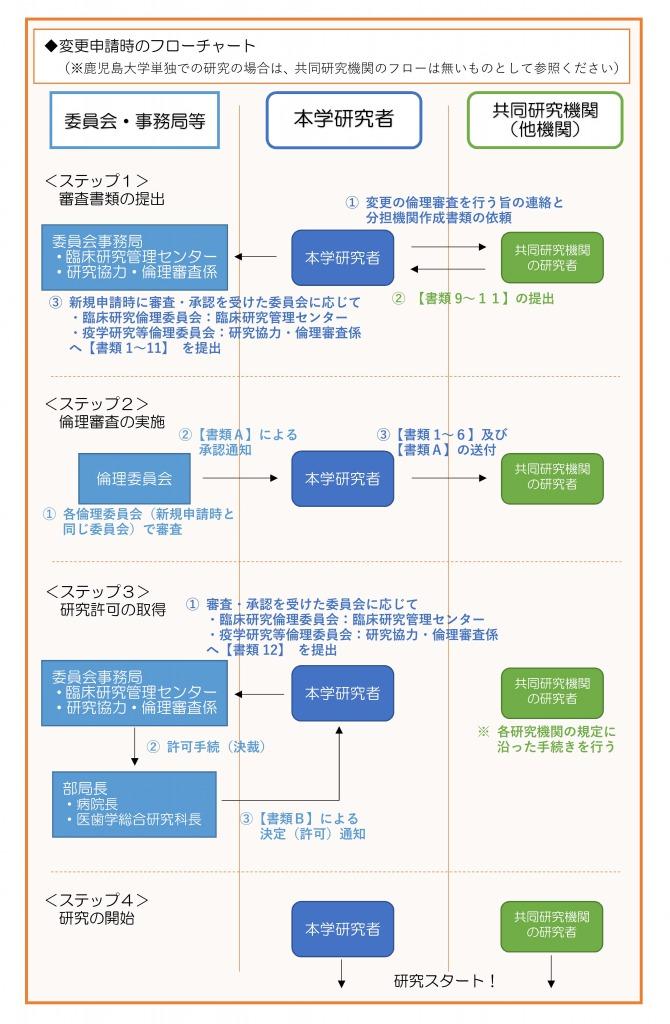
◆研究者が作成する書類(※下記フローチャートの【書類1~12】に対応しております)
※◎印の書類は多機関共同研究の場合のみ作成
1.生命科学・医学系研究倫理審査申請書(変更)★
2.研究者等リスト ★
3.生命科学・医学系研究実施計画書 ★
4.説明文書、同意書、同意撤回通知書 ★
5.情報公開文書 ★
6.変更対比表 ★
7.他の研究機関への試料・情報の提供に関する届出書 ★
8.審査形態確認書 ★ ◎
9.研究分担機関の確認書【多機関共同研究に参加する研究分担機関用】☆ ◎
10.研究機関要件確認書 ☆ ◎
11.研究者等リスト(多機関共同研究に参加する研究分担機関分)☆ ◎
12.研究実施許可願の申請書 ★
(書類の作成者について)
★印:本学の研究者が作成
☆印:本学が多機関共同研究の代表研究機関として申請を行う際に、共同研究機関の研究者が作成。
(書類作成時の留意事項)
※4、5は研究内容に応じて二者択一で提出、もしくは両方提出。
※7は研究内容に応じて必要な場合のみ提出。
※9、10、11(☆印の書類)は研究分担機関が作成の上、代表機関(本学)に提出。
※本学の倫理審査に必要な書類は1~11まで。12は下記Aの書類(審査結果通知書)を受領後に提出。
(書類の提出先)
※新規申請時に審査・承認された委員会の事務局へ提出。
→臨床研究倫理委員会で審査・承認の場合:大学病院・臨床研究管理センター
疫学研究等倫理委員会で審査・承認の場合:医歯学総合研究科等総務課研究協力・倫理審査係
◆倫理委員会(委員会事務局)が作成する書類(※下記フローチャートの【書類A・B】に対応しております)
A.審査結果通知書
B.研究に関する決定通知書
※Aは倫理委員会での承認後、委員会(事務局)で作成し、本学研究者に通知。
※Bは研究者から委員会(事務局)へ上記12の書類(研究実施許可願の申請書)を提出後、部局長の許可(決裁)を経て、本学研究者へ通知。
※以下の画像をクリックしますと別ウインドで開きます。
(※本学が多機関共同研究の共同研究機関となる研究)
基本的な提出書類や手続きの流れなどは「(2)新規申請について(※本学が多機関共同研究の共同研究機関となる研究)」と同様ですので、そちらをご参照ください。
倫理審査は同様に原則として代表機関にて一括で行われることとなっておりますが、本学が要因となる変更の場合には、まずは代表機関にご連絡ください。
生命科学・医学系研究に関する倫理指針では、利益相反の管理について以下のとおり定めています。
⑴ 研究者等は、研究を実施するときは、個人の収益等、当該研究に係る利益相反に関する状況について、その状況を研究責任者に報告し、透明性を確保するよう適切に対応しなければならない。
⑵ 研究責任者は、医薬品又は医療機器の有効性又は安全性に関する研究等、商業活動に関連し得る研究を実施する場合には、当該研究に係る利益相反に関する状況を把握し、研究計画書に記載しなければならない。
⑶ 研究者等は、⑵の規定により研究計画書に記載された利益相反に関する状況を、第8に規定するインフォームド・コンセントを受ける手続において研究対象者等に説明しなければならない。
企業から提供された資金に基づく研究を実施するなど利益相反管理が必要だと思われる場合は、倫理審査委員会の開催前に、利益相反審査委員会の事前の審査が必要になることがあります。ご不明な点がありましたらお問い合わせください。
・厚生労働省「厚生労働科学研究に関する指針」(学外サイト )
・![]() (参考)利害関係者(学生等)を被験者に選定する際の取扱について(2021年1月21日 第24回疫学研究等倫理委員会)
(参考)利害関係者(学生等)を被験者に選定する際の取扱について(2021年1月21日 第24回疫学研究等倫理委員会)
・医歯学総合研究科等総務課 研究協力・倫理審査係(内線6090)
メールアドレス このメールアドレスはスパムボットから保護されています。閲覧するにはJavaScriptを有効にする必要があります。
場所:医歯学総合研究科棟1(歯学系)2階 キャンパスマップ
※歯科診療棟裏の白い9階建ての建物です。