大学院医歯学総合研究科の城山助教、奥野教授らは、東京大学医科学研究所、東京大学先端科学技術研究センターおよび東京大学大学院医学系研究科との共同研究により、急性ストレス下にて過度な情動表出を抑制する分子および神経回路を明らかにしました。本成果は、2022年1月8日に国際学術雑誌「Molecular Psychiatry」に掲載されました。
(全学HPのニュース・トピックス掲載はこちら)
【本研究成果のポイント】
- 神経ペプチドであるGRP(gastrin-releasing peptide)を遺伝的に欠損するマウスを作製しました。
- GRPの欠損により、短時間の急性ストレス後に過度な情動表出を示しました。
- 神経活動により蛍光タンパクVenusを発現するマウスを利用し、ストレス下での情動表出に関わる神経回路の同定を試みました。
- その結果、Amygdalostriatal transition area(AST)という脳領域では、ストレス下の情動学習でのみ、顕著に神経活動が亢進しました。
- さらに、このASTの神経活動亢進は、GRP遺伝子の欠損によって抑制されました。
- 以上の結果により、急性ストレス下にて過度な情動表出を抑制する分子および神経回路が同定されました。
- 長期的なストレスはもとより、短時間の比較的軽いストレスにおいてもその耐性には個人差があります。これらストレス耐性の分子的・神経回路的実体を特定した本成果は、今後の応用に大きく貢献すると期待されます。
1, 研究の背景
長期間の強いストレスが心身に強い悪影響を及ぼすことは、心的外傷後ストレス障害(PTSD)を例にとるまでもなく広く知られています。一方で、短時間の比較的軽いストレス経験によっても、その後数分~数時間において心身の状態が乱れることはほぼ全ての人が経験されていることと思いますが、その分子・神経回路の実体はあまり知られていません。これまで百種以上知られている神経ペプチドのひとつであるGRPは扁桃体外側核(LA)で強く発現しています(図1)。またGRPは20分程度の拘束ストレスにより神経伝達物質としての放出が促進されることが知られています。LAは音などの感覚刺激や電気ショックなどの嫌悪刺激を受容して基底核(BA), 中心核 (CeA), ASTなどに神経投射しつつ情動的な記憶を司ると考えられていることから(図1)、ストレス下における情動制御に大きな役割を果たすと予想されます。そこで当研究グループは、GRP遺伝子が欠失したマウスを作製し、短時間のストレスの有無における行動変化を解析しました。
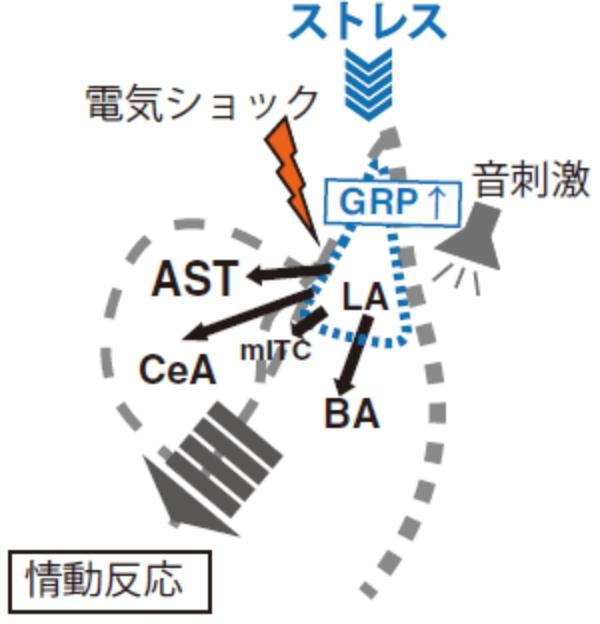
図1、
扁桃体の模式図。GRPは扁桃体の中でも特にLAで強く発現し(青点線枠)、ストレス負荷により放出が促進される。扁桃体LAは、音の様な感覚刺激および足からの電気ショックの様な侵害刺激を受容し、他の扁桃体領域へ神経軸索投射(矢印)を通じて情動的な記憶を司る。GRPはLAの投射先となる神経細胞活性化の調節を通じてストレス下で情動反応の表出に関与することが予測される。
LA, 外側核; BA, 基底核; mITC, 中間介在ニューロン; CeA, 中心核; AST, amygdalostriatal transition area
2, 研究の概要・結果
GRP遺伝子の欠損マウスにおいて音と電気ショックを同時に与え、音に対する恐怖記憶をすくみ反応時間を指標にして解析しました。その結果、通常時は、GRP遺伝子欠損マウスもGRP遺伝子を保有するマウス(野生型)も、すくみ反応時間に顕著な差がありませんでした(図2、左)。一方で、マウスを20分間拘束し、動けなくすることでストレスをかけ、恐怖学習テストを行ったところ、GRP欠損マウスで過度なすくみ反応を示しました(図2、右)。以上の結果は、GRPがストレス下にて過度な情動表出を抑制することを示します。
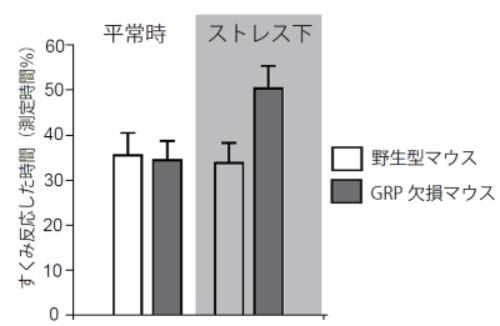
図2、
音と電気ショックを組み合わせて与える恐怖学習を行い、後日に音に対する恐怖反応(すくみ反応)の評価を行った。GRP欠損マウスは、平常時に恐怖学習を行ってもすくみ反応の程度は野生型と比較して差は無い(左)。しかし、事前に20分間の拘束ストレスを負荷すると、GRP欠損マウスは過度なすくみ反応を示す。エラーバーは標準誤差を示す。
このストレス下での情動学習を担う脳神経回路を同定するため、我々は神経活動に伴いその発現が亢進する最初期遺伝子であるArcのプロモーターを利用した、Arc-Venus 遺伝子導入マウスを導入しました(図3上)。このマウスを用いると、活動した神経細胞がその後数時間にわたって蛍光を発します(図3下左)。更に我々は、脳試料を透明にすることで活動した神経細胞の蛍光を検出し易くし、緻密で詳細な神経活動解析方法を確立しました(図3、下右)。
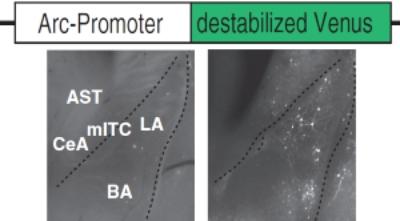
図3、
神経活動に伴い発現が亢進する最初期遺伝子であるArcのプロモーター下に不安定化(destabilized)させた蛍光タンパク(Venus)を連結した遺伝子導入マウスの遺伝子構成(上)。この遺伝子が導入されたマウス(Arc-Venusマウス)における扁桃体のスライスの写真(下左)。研究発表者らは、このスライスを透明化して背景のノイズを除去することにより、感度のよい神経活動の解析を可能にした(下右)。
GRPが発現するLAは扁桃体における情報の入り口であり、基底核(BA)や中心核(CeA)を含む多くの脳部位に神経伝達していることが知られています(図1、矢印)。そこで我々は、これらの部位を含む扁桃体のほぼ全領域での神経活動解析を行い、活動した神経細胞を扁桃体の疑似的マップ上にプロットしました(図4)。無処置、ストレス無しの恐怖学習、およびストレス下で恐怖学習を行った野生型マウスでは、それぞれ個性的な扁桃体内での神経活動パターンの変化を示します(図4)。またGRP欠損マウスでは、野生型と比較して神経活動パターンの変化が示唆されます(図4)。
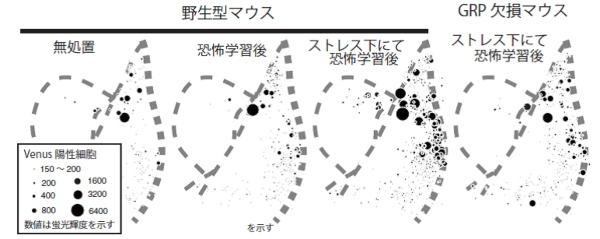
図4、
扁桃体内においてVenusを発現する細胞の位置的プロット。疑似的な扁桃体の輪郭に対し、Venus発現細胞の相対的位置とVenus蛍光輝度(Arc promoter活性を反映)を反映させたドットをプロットしている。それぞれ6匹ずつの結果を重ね合わせている。
プロット上で神経活動に変化がありそうな部位を切り出して詳細な再解析を行ったところ、ASTでのみ、ストレス下での恐怖学習時に活動した神経細胞が増加し、更にGRPの欠損によってその増加が消失することが判明しました(図5)。この結果は、ASTの神経細胞のみがストレス下での恐怖学習により活性化し、その活性化の要因がGRPにより担われることを示します。
以上の結果から、急性ストレス下にて過度な情動表出を抑制する分子および神経回路が同定できました。
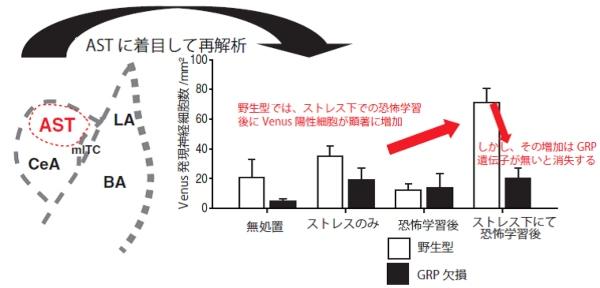
図5、
ASTの位置(左)と、そこを切り出して再度Venus陽性細胞数を測定した結果(右)。野生型マウスにおいて、ストレス下にて恐怖学習を行ったマウスでは、他の3つの処置を行ったマウスと比較し、有意にVenus発現神経細胞数が増加する(左赤矢印)。しかし、その増加はGRP欠損で消失する(右赤矢印)。野生型・GRP欠損マウスの全ての行動処置群にて、6匹ずつを使用し集計。
3, 今後の展開
本研究結果で、神経ペプチドGRPや扁桃体近傍に存在する脳領域であるASTの役割が解明されたことにより、急性ストレス下での耐性を司るメカニズムの研究が大きく飛躍することが見込まれます。近年、脳領域特異的な神経活動操作による脳機能研究が大きく発展しています。ASTはとても小さな脳領域であり、この部位に特異的な神経活動操作は極めて困難な状況にありますが、各種遺伝子操作法を駆使して達成すべく研究を進めているところです。
4, 研究成果の公表
これらの研究成果は、2022年1月8日に国際学術雑誌「Molecular Psychiatry」に掲載されました。
論文タイトル:
Gastrin-releasing peptide regulates fear learning under stressed conditions via activation of the amygdalostriatal transition area
著者:
後藤史子、城山優治(鹿児島大学大学院医歯学総合研究科/責任著者)、小川糸音、奥野浩行(鹿児島大学大学院医歯学総合研究科)、市瀬多恵子、市瀬広武、穴井元暢、児玉龍彦、吉田進昭、尾藤晴彦、真鍋俊也(責任著者)
doi: 10.1038/s41380-021-01408-3
【本研究に関するお問い合わせ】
生化学・分子生物学分野
城山 優治[Researchers]
研究室紹介















